Hoe Bereken Je De Molariteit In Chemische Oplossingen
Molariteit
Keywords searched by users: hoe bereken je de molariteit wat is molariteit, molariteit eenheid, hoe bereken je mol, concentratie berekenen mg/ml, hoeveel gram is 1 mol stikstof, is molariteit hetzelfde als concentratie, hoe bereken je de molaire massa, molaire concentratie
Wat is molariteit en waarom is het belangrijk?
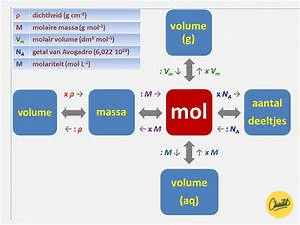
Molariteit, ook wel bekend als molaliteit of molaire concentratie, is een belangrijk begrip in de scheikunde. Het verwijst naar de concentratie van een stof in een oplossing en geeft aan hoeveel mol van die stof er aanwezig is per liter oplossing. Molariteit wordt vaak aangeduid met de letter M en heeft als eenheid mol/L.
Molariteit is belangrijk omdat het ons in staat stelt om de samenstelling en eigenschappen van oplossingen te kwantificeren. Het helpt ons begrijpen hoeveel deeltjes van een stof er aanwezig zijn in een bepaald volume van een oplossing. Dit is essentieel bij het uitvoeren van chemische reacties, het berekenen van concentraties en het bepalen van het volume van oplossingen dat nodig is om een specifieke hoeveelheid van een stof te verkrijgen.
Daarnaast is molariteit een belangrijk concept bij het analyseren en interpreteren van experimentele gegevens. Het stelt wetenschappers in staat om de juiste hoeveelheid van een stof toe te voegen aan een reactie of om de effectiviteit van een bepaalde reactieconditie te bepalen.
Hoe bereken je het aantal mol van een stof?
Om het aantal mol van een stof te berekenen, moet je de massa van de stof en de molmassa ervan kennen. De molmassa is de massa van één mol van een stof en wordt uitgedrukt in gram/mol.
De formule om het aantal mol te berekenen is:
Aantal mol = massa / molmassa
Stel dat je bijvoorbeeld 50 gram water (H2O) hebt en de molmassa van water is 18 g/mol. Het aantal mol water kan worden berekend als volgt:
Aantal mol water = 50 g / 18 g/mol = 2,78 mol
Op dezelfde manier kun je het aantal mol van andere stoffen berekenen door de gegeven massa te delen door de molmassa van de stof.
Hoe vind je de molmassa van een stof?
De molmassa van een stof is de massa van één mol van die stof en wordt uitgedrukt in gram/mol. Om de molmassa van een stof te vinden, moet je de atoommassa van elk element in de chemische formule van de verbinding vermenigvuldigen met het aantal atomen van dat element en deze waarden bij elkaar optellen.
Bijvoorbeeld, om de molmassa van water (H2O) te vinden, moet je de atoommassa van waterstof (H) vermenigvuldigen met het aantal waterstofatomen in de formule (2) en de atoommassa van zuurstof (O) vermenigvuldigen met het aantal zuurstofatomen in de formule (1):
Molmassa van water = (atoommassa van waterstof x aantal waterstofatomen) + (atoommassa van zuurstof x aantal zuurstofatomen)
= (1,008 g/mol x 2) + (16,00 g/mol x 1)
= 2,016 g + 16,00 g
= 18,02 g/mol
Op dezelfde manier kun je de molmassa van andere stoffen berekenen door de atoommassa’s van de elementen in de formule te vermenigvuldigen met het aantal atomen en deze waarden bij elkaar op te tellen.
Hoe bereken je het aantal gram van een stof?
Om het aantal gram van een stof te berekenen, moet je het aantal mol van de stof en de molmassa ervan kennen. De molmassa is de massa van één mol van een stof en wordt uitgedrukt in gram/mol.
De formule om het aantal gram te berekenen is:
Aantal gram = aantal mol x molmassa
Stel dat je bijvoorbeeld 2 mol water (H2O) hebt en de molmassa van water is 18 g/mol. Het aantal gram water kan worden berekend als volgt:
Aantal gram water = 2 mol x 18 g/mol = 36 g
Op dezelfde manier kun je het aantal gram van andere stoffen berekenen door het aantal mol te vermenigvuldigen met de molmassa van de stof.
Hoe bepaal je het volume van een oplossing?
Om het volume van een oplossing te bepalen, moet je het aantal mol van de opgeloste stof en de molariteit van de oplossing kennen. De molariteit is het aantal mol van een stof per liter oplossing.
De formule om het volume te berekenen is:
Volume = aantal mol / molariteit
Stel dat je bijvoorbeeld 0,5 mol zout (NaCl) hebt en je hebt een oplossing met een molariteit van 2 mol/L. Het volume van de oplossing kan worden berekend als volgt:
Volume = 0,5 mol / 2 mol/L = 0,25 L of 250 mL
Op dezelfde manier kun je het volume van een oplossing berekenen door het aantal mol van de opgeloste stof te delen door de molariteit van de oplossing.
Hoe vind je de molariteit van een oplossing?
Om de molariteit van een oplossing te vinden, moet je het aantal mol van de opgeloste stof en het volume van de oplossing kennen. De molariteit wordt uitgedrukt in mol/L.
De formule om de molariteit te berekenen is:
Molariteit = aantal mol / volume
Stel dat je bijvoorbeeld 0,5 mol zout (NaCl) hebt en je hebt een oplossing met een volume van 0,25 L. De molariteit van de oplossing kan worden berekend als volgt:
Molariteit = 0,5 mol / 0,25 L = 2 mol/L
Op dezelfde manier kun je de molariteit van andere oplossingen berekenen door het aantal mol van de opgeloste stof te delen door het volume van de oplossing.
Hoe bereken je de molaire massa van een oplossing?
De molaire massa van een oplossing kan worden berekend door het gewicht van de opgeloste stof en het volume van de oplossing te kennen. De molaire massa wordt uitgedrukt in gram/mol.
De formule om de molaire massa te berekenen is:
Molaire massa = gewicht / volume
Stel dat je bijvoorbeeld 25 gram natriumchloride (NaCl) hebt en je hebt een oplossing met een volume van 0,1 L. De molaire massa van de oplossing kan worden berekend als volgt:
Molaire massa = 25 g / 0,1 L = 250 g/mol
Op dezelfde manier kun je de molaire massa van andere oplossingen berekenen door het gewicht van de opgeloste stof te delen door het volume van de oplossing.
Hoe bepaal je de dichtheid van een oplossing?
Categories: Aggregeren 44 Hoe Bereken Je De Molariteit

We weten ook in hoeveel liter de stof is opgelost, de volume. De volume is 1,5 liter. Om de molariteit uit te rekenen delen we het aantal mol door de volume: 0,034 / 1,5 = 0,023 M (mol/L) NaCl.Je kunt het aantal mol uitrekenen door het aantal gram te delen door de molaire massa. Dan krijg je dus: 32 g/16,0 g/mol = 2 mol zuurstof. Als je het aantal mol van een stof weet en je wil weten hoeveel liter je hebt, heb je hier de molariteit voor nodig.Molariteit (M) is het aantal mol van een stof per liter oplossing. Massa/volume percentage (m/v%) is de massa van de opgeloste stof in gram per 100 ml oplossing.
Hoe Moet Je Molariteit Berekenen?
Als je vervolgens wilt weten hoeveel liter (volume) je hebt aan de hand van het aantal mol van een stof, heb je de molariteit nodig. Molariteit is in feite de concentratie van een stof in een oplossing, uitgedrukt als het aantal mol per liter (mol/L).
Dus, om het aantal liter te berekenen aan de hand van het aantal mol en de molariteit, kun je de formule gebruiken: volume = aantal mol / molariteit.
Wat Is De Molariteit Van Een Stof?
Molariteit (M) is een maat voor de concentratie van een stof en wordt uitgedrukt in het aantal mol van de stof per liter oplossing. Het geeft aan hoeveel mol van de stof er aanwezig is in elke liter oplossing.
Daarnaast hebben we ook de massa/volume percentage (m/v%), wat aangeeft hoeveel gram van de opgeloste stof er aanwezig is in elke 100 ml oplossing. Dit wordt berekend door de massa van de opgeloste stof te delen door het volume van de oplossing (in dit geval 100 ml) en vervolgens te vermenigvuldigen met 100. Het m/v% geeft dus de verhouding weer van de opgeloste stof ten opzichte van het oplosmiddel.
Hoe Van Mol Naar Molariteit?
Hoe Bereken Je Molaire Massa Formule?
Update 20 hoe bereken je de molariteit
![Wat is concentratie en molariteit? Wat betekent [Ar]=0,25M ? - YouTube Wat Is Concentratie En Molariteit? Wat Betekent [Ar]=0,25M ? - Youtube](https://i.ytimg.com/vi/uYTLzC_om3M/maxresdefault.jpg)





See more here: c3.castu.org
Learn more about the topic hoe bereken je de molariteit.
- Molariteit berekenen Scheikunde HAVO – DeBijlesStudent
- Rekenen met mol: wat is mol en hoe kun je hier mee rekenen?
- [Solved] Bereken de molariteit en de mv als de mM 20 is en de dichtheid
- De mol: wat is het en hoe reken je ermee? – ExamenOverzicht
- Hoe reken je met mol? | StudyGo
- Rekenen met mol: wat is mol en hoe kun je hier mee rekenen? – Mr. Chadd
See more: https://c3.castu.org/danh-muc/suc-khoe